Gelöster Sauerstoff (DO) ist Sauerstoffgas (O2), welches in Wasser gelöst ist. Gase in der Atmosphäre wie Sauerstoff, Stickstoff und Kohlendioxid lösen sich auf natürliche Weise bis zu einem gewissen Grad in Wasser. Wie Salz oder Zucker sind diese Gase im Wasser unsichtbar sobald sie sich aufgelöst haben.
Das Element Sauerstoff kommt in der Natur in vielen Formen vor. Obwohl die meisten Menschen wissen, dass Sauerstoff Teil des Wassermoleküls ist, wären die meisten überrascht zu hören, dass Sauerstoff auch das am häufigsten vorkommende Element in Gesteinen ist. In diesen Formen ist Sauerstoff an andere Elemente wie Wasserstoff, Silizium oder Kohlenstoff gebunden. Molekularer Sauerstoff (O2), der sich in Luft befindet, unterscheidet sich von anderen Formen, da er nicht an andere Elemente gebunden ist. In der Natur ist das O2, das wir atmen, chemisch viel reaktiver als die häufiger vorkommenden Formen von Sauerstoff, mit denen wir in Kontakt kommen. Dies ermöglicht es Pflanzen, Tieren und anderen Organismen, O2 zu verwenden, um ihre Nahrung durch den Atmungsprozess zu metabolisieren.
Konzentration und Löslichkeit
Die Menge (Konzentration) an in Wasser gelöstem O2 wird am häufigsten in Milligramm pro Liter Wasser (mg / l) ausgedrückt. Diese Konzentration wird als Gehalt an gelöstem Sauerstoff (DO) im Wasser bezeichnet. Es besteht eine natürliche Tendenz, dass Wasser in Kontakt mit Luft O2 löst, bis die Sättigungskonzentration erreicht ist. Beispielsweise beträgt der Sauerstoffgehalt in Süßwasser bei 25 ° C in Kontakt mit Luft 8,3 mg / l, vorausgesetzt, dass das Gleichgewicht zwischen Wasser und Luft erreicht ist und nichts das O2 aus dem Wasser entfernt.
DO-Konzentrationen werden manchmal als % der Sättigung ausgedrückt. Wenn der Sauerstoffgehalt des Wassers die Sättigungskonzentration aufweist, spricht man von einer 100% igen Sättigung. Wenn der Sauerstoffgehalt beispielsweise in Süßwasser mit 25 ° C 5,0 mg / l beträgt, ist er zu 60% gesättigt (5,0 geteilt durch den Sättigungsgrad von 8,3 mg / l, multipliziert mit 100%).
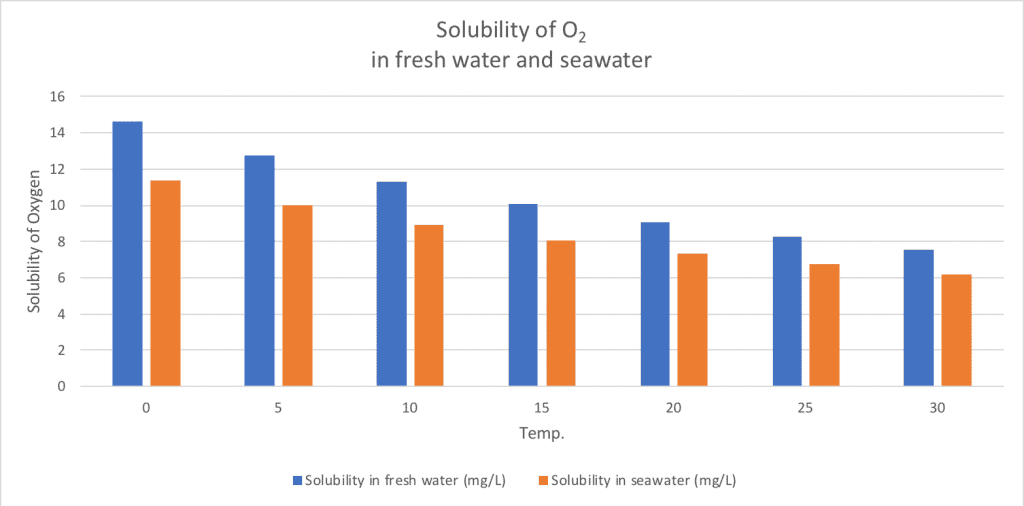
Diese Sättigungskonzentration ist als Löslichkeit von O2 bekannt, dh der Menge an O2, die Wasser aufnehmen kann. Die Löslichkeit von O2 ändert sich mit Temperatur, Salzgehalt und Druck. Die Löslichkeit von O2 in Wasser nimmt mit abnehmender Temperatur zu, was bedeutet, dass kaltes Wasser mehr O2 aufnehmen kann. Beispielsweise enthält kaltes Wasser bei 5 ° C (12,8 mg / l) etwa 55% mehr gelösten Sauerstoff als warmes Wasser bei 25 ° C (8,3 mg / l) [1].
Da die Wassertemperatur mit den Jahreszeiten variiert, sind die Sauerstoffgehalte in den kühleren Monaten tendenziell höher, da die Löslichkeit von O2 in kaltem Wasser höher ist. Im Sommer ist der Wasserstand tendenziell niedriger und die Luft wärmer, was zu wärmerem Wasser und niedrigeren Sauerstoffwerten führt.
Der Salzgehalt von Wasser beeinflusst auch die Löslichkeit von O2, so dass Meerwasser etwa 20% weniger O2 als Süßwasser enthalten kann [1].
Quelle: [1]
Die Löslichkeit von gelöstem Sauerstoff ändert sich mit der Temperatur und dem Salzgehalt.
Druck beeinflusst auch die Löslichkeit von O2. Der Wasserdruck in einer bestimmten Tiefe hängt von der Höhe der Wassersäule darüber ab, sodass der Druck mit der Tiefe zunimmt. Wasser mit höherem Druck kann mehr O2 enthalten, was bedeutet, dass die Löslichkeit von O2 in größeren Tiefen zunimmt. Beispielsweise kann Wasser in 4 m Tiefe etwa 40% mehr O2 enthalten als Wasser an der Oberfläche [2].
Es ist möglich, dass Wasser einen Sauerstoffgehalt aufweist, der höher ist als die Löslichkeit von O2 (mehr als 100% Sättigung). Dieser Zustand wird als Übersättigung bezeichnet und kann unter besonderen Umständen auftreten (siehe unten).
Quellen und Senken von O2 im Wasser
Die Hauptquelle für O2 im Wasser ist die Atmosphäre. Sauerstoffmoleküle treten an der Wasseroberfläche langsam in Wasser ein. Dieser Prozess wird auf natürliche Weise durch turbulent fließendes Wasser, Wind und Wellen unterstützt. Aus diesem Grund hat stilles Wasser tendenziell niedrigere Sauerstoffwerte als sich schnell bewegendes Wasser. Die natürliche Belüftung von Wasser durch Stromschnellen oder Wasserfälle oder künstlich durch Luftblasen durch Wasser, Drehen von Wasserrädern oder Verschütten durch Dämme beschleunigt die Übertragung von O2 von Luft zu Wasser erheblich. O2 gelangt auch aus Nebenflüssen und Grundwasserabflüssen in Gewässer.
O2 in Wasser entsteht auch durch Photosynthese, bei der Pflanzen und Algen gelöstes Kohlendioxid (CO2) in organische Stoffe umwandeln und O2 ins Wasser abgeben. Die Photosynthese findet nur zu Tageszeiten statt, zu denen Licht vorhanden ist. Die Tiefe, in der die Photosynthese stattfindet, hängt von der Klarheit des Wassers ab. In trübem Wasser erreicht das Licht möglicherweise nicht den Grund eines tiefen Sees.
Wasserpflanzen, Tiere und Mikroben verbrauchen O2 durch Atmung, wobei organisches Material, das als Brennstoff verwendet wird, wieder in CO2 umgewandelt wird. Dies ist das Gegenteil von Photosynthese. Viele Menschen sind überrascht zu erfahren, dass Pflanzen O2 sowohl verbrauchen als auch produzieren. Pflanzen verbrauchen nachts O2 durch Atmung und setzen tagsüber O2 durch Photosynthese frei. Aus diesem Grund nimmt der Sauerstoffgehalt in einigen aquatischen Umgebungen nachts tendenziell ab und tagsüber zu.
Mikroben und Pilze verbrauchen auch O2 durch Zersetzung toter organischer Stoffe. Dies geschieht häufig in tieferen Schichten der Wassersäule, wenn totes Material nach unten sinkt. Aus diesem Grund weisen tiefere Wasserschichten häufig einen niedrigeren Sauerstoffgehalt auf als flache Schichten.
DO und Wasserleben
Verschiedene Arten von Wassertieren haben unterschiedliche DO-Anforderungen. Tiere, die sich am Boden eines Gewässers ernähren, wo die Sauerstoffkonzentrationen tendenziell niedriger sind, können typischerweise niedrigere Sauerstoffkonzentrationen tolerieren, die Tiere in der Nähe der Oberfläche haben. Die meisten Fische können bei Sauerstoffkonzentrationen von 5 mg / l oder mehr überleben und wachsen, obwohl das Laichen und ein optimales Wachstum höhere Konzentrationen erfordern können [3].
Wenn der Sauerstoffgehalt für eine bestimmte Art zu niedrig ist, kann das Tier lethargisch werden oder sterben. Hypoxie ist eine Erkrankung, bei der der Sauerstoffgehalt niedrig genug ist, um Wassertierarten zu bedrohen. Hypoxie kann tote Zonen in Gewässern verursachen, in denen Fische und andere Wasserlebewesen fehlen. Ein Sauerstoffgehalt von weniger als 1-2 mg / l wird im Allgemeinen als hypoxisch angesehen, und ein Gehalt von weniger als 3 mg / l gibt Anlass zur Sorge. Diese Werte liegen unter den Anforderungen für das Laichen und Wachstum der meisten Fische.
Im entgegengesetzten Extrem kann eine Übersättigung des Wassers mit O2 zu gesundheitlichen Problemen bei Fischen führen. Übersättigung entsteht, wenn die Löslichkeit von O2 in Wasser schnell abnimmt oder wenn O2 durch Photosynthese schnell erzeugt wird. Die Löslichkeit von O2 kann beispielsweise bei steigender Wassertemperatur abnehmen, so dass ein schneller Anstieg der Wassertemperatur zu einer Übersättigung führen kann. Übersättigung mit O2 kann bei Fischen einen Gesundheitszustand verursachen, der als Gasblasenkrankheit bezeichnet wird.
Umweltauswirkungen auf DO
Da die meisten Wasserorganismen gelöstes O2 benötigen, wird der Sauerstoffgehalt eines Gewässers häufig zur Beurteilung seiner Gesundheit verwendet. Der Sauerstoffgehalt in Gewässern kann durch eine Reihe verschiedener Umweltprobleme beeinflusst werden. Zum Beispiel können Abflüsse, die mit Abholzungen oder landwirtschaftlichen Abfällen verbunden sind, überschüssiges organisches Material in Gewässer befördern, was zur Erschöpfung von O2 führen kann, wenn das Material zersetzt wird.
Ein weiteres Problem sind übermäßige Nährstoffe, die durch Abfluss von Düngemitteln auf landwirtschaftlichen Flächen oder Erholungsgebieten (z. B. Golfplätzen) oder aus Kläranlagen in Gewässer gelangen können. Übermäßige Nährstoffe können zu Algenblüten führen, ein Prozess, der als Eutrophierung bekannt ist. Algenblüten können verhindern, dass Licht in Wasserpflanzen gelangt, und tote Algen stellen eine Quelle für organische Stoffe dar, die bei ihrer Zersetzung den Sauerstoffgehalt senken können. Da die toten Algen sinken, betrifft dieses Problem insbesondere tiefere Wasserschichten und Tiere, die auf dem Boden oder dem Bett des Gewässers wohnen.
Die Ufervegetation (Pflanzen, die an den Ufern eines Baches oder Flusses leben) schützt den Sauerstoffgehalt der Bäche, indem sie Schatten spendet, der das Wasser kühl hält. Wenn diese Vegetation entfernt wird, kann sich jedoch die Wassertemperatur erhöhen, was zu einem entsprechenden Abfall des Sauerstoffgehalts führt.
Die Wassertemperatur kann auch durch andere menschliche Aktivitäten beeinflusst werden. Wenn Wasser für Trinkwasser, Bewässerung oder industrielle Zwecke entnommen oder gespeichert wird, insbesondere in trockenen Monaten, kann der Wasserstand in Strömen sinken, wodurch sie besonders anfällig für Temperaturschwankungen und Erwärmung sind. Die daraus resultierende Abnahme des Sauerstoffgehalts kann das Leben im Wasser in diesen Gewässern schädigen. Wenn Wasser für industrielle Kühlprozesse verwendet und dann in einen Strom zurückgeführt wird, ist seine Temperatur häufig höher als das Wasser im Strom, was zu einer Erwärmung des Stroms und einer Verringerung seines Sauerstoffgehalts führt.
Fazit
Gelöster Sauerstoff wird durch viele verschiedene Faktoren und Prozesse in Gewässern beeinflusst und kann über kurze Zeiträume schwanken. Glücklicherweise können die meisten Wasserlebewesen kurze Zeiträume tolerieren, in denen der Sauerstoffgehalt niedrig ist. Anhaltende Probleme mit niedrigen Sauerstoffwerten können jedoch zu einer schlechten Gesundheit der aquatischen Umwelt führen. Aus diesem Grund ist die routinemäßige Überwachung des Sauerstoffgehalts wichtig, wenn Bedenken hinsichtlich der Gesundheit von Wasserlebewesen bestehen.
Verweise
[1] American Public Health Association (APHA) (2005) Standard methods for examination of water and wastewater, 21st edn. APHA, AWWA, WPCF, Washington.
[2] FAO. (2014). Site selection for aquaculture: Chemical features of water. Washington, DC: Fisheries and Aquaculture Department, www.fao.org.
[3] U.S. Environmental Protection Agency (1986) Ambient water quality criteria for dissolved oxygen. EPA 440/5-86-003.

